声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及);本文不构成任何投资建议。
9月17日,Merck和第一三共宣布其ADC药物patritumab deruxtecan(HER3-DXd)已通过了3期HERTHENA-Lung 02研究。在今年的ESMO会议结束几个月后,该药物因生产问题被美国FDA拒之门外。根据公布的结果,两家公司将与全球监管单位就该试验结果进行进一步的讨论。

Patritumab deruxtecan是一款采用第一三共技术设计的潜在first-in-class靶向HER3的DXd ADC,目前正由第一三共公司和Merck联合开发。
HERTHENA-Lung02 3期试验评估了patritumab deruxtecan(HER3-DXd)对既往接受过EGFR酪氨酸激酶抑制剂(TKI)治疗的局部晚期或转移性表皮生长因子受体突变非小细胞肺癌(NSCLC)患者的治疗效果,该试验达到了无进展生存期(PFS)的主要终点,与铂类加培美曲塞诱导化疗及后续培美曲塞维持疗法相比,PFS有显著的统计学改善。在进行分析时,总生存期(OS)数据尚不成熟,该试验将继续进一步评估次要终点OS。
HERTHENA-Lung02的安全性与在之前肺癌临床试验中的安全性一致,没有发现新的安全性信号。大多数间质性肺病(ILD)事件级别较低(1级和2级)。观察到两例5级间质性肺病事件(表面患者已死亡),在其第2阶段研究中也曾发现了一例5级 ILD 病例。
这项合作开始于2023年10月,第一三共和默沙东就第一三共的三款ADC候选药物:patritumab deruxtecan(HER3-DXd)、ifinatamab deruxtecan(I-DXd)和raludotatug deruxtecan(R-DXd)达成了全球开发和商业化协议,将在全球范围内共同开发和潜在商业化这些候选ADC疗法。第一三共将保留日本的独家权利。第一三共将全权负责产品生产和供应。
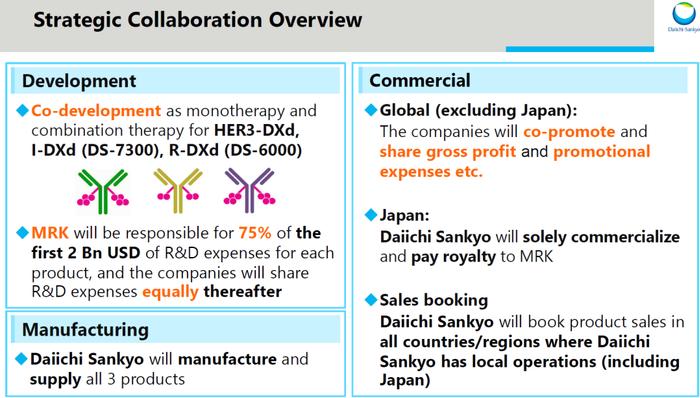
根据协议,ifinatamab deruxtecan项目默沙东将向第一三共支付15亿美元的预付款;patritumab deruxtecan项目和raludotatug deruxtecan项目的预付款分别也是15亿美元。根据某些销售里程碑的实现情况,默沙东还将为每个项目支付额外的55亿美元里程金。结合其他合作条款,三个项目的潜在交易总价值高达220亿美元。
2024年8月6日,第一三共与默沙东共同宣布扩大了现有的三项研究性DXd抗体偶联药物的全球共同开发和共同商业化协议,将默克公司的MK-6070(一种研究性δ样配体3 (DLL3)靶向T细胞结合器)纳入其中。这款药物是默沙东此前斥资约6.8亿美元收购Harpoon Therapeutics获得的。
根据协议,默沙东将获得1.7亿美元预付款,以及根据销售额收取一定的特许权使用费,两家公司将在全球(除日本)共同开发和商业化 MK-6070,默沙东将保留该药物在日本的独家代理权。此外,默沙东负责MK-6070的生产和供应,并记录该产品的全球销售额。与MK-6070和ifinatamab deruxtecan联合使用相关的研发费用将按照ifinatmab deruxtecan的原始协议进行分摊。
今年6月26日,FDA拒批了第一三共和默沙东提交的加速批准Patritumab Deruxtecan(HER3-DXd)的生物制品许可申请(BLA),CRL指出原因是在第三方制造设施的检查发现问题,并未指出申请中提交的功效或安全性数据存在任何问题。第一三共表示将与FDA和第三方制造商密切合作,尽快解决反馈问题。
参考资料:公司官网